Pandemi virus corona atau Covid-19 belum juga usai. Sementara para ilmuwan tengah berpacu mengembangkan obat dan vaksin untuk menghalau penyebaran dan tingkat kematian dari virus yang terdeteksi pertama kali di Wuhan, China pada akhir 2019 lalu ini.
Tak kalah dari negara lain, Indonesia juga mengebut pengembangan vaksin untuk mengendalikan penyebaran virus di Indonesia yang sudah menjangkit lebih dari 100.000 orang per akhir Juli 2020. Untuk itu pemerintah menggenjot kerja sama antara industri medis di Indonesia, yang diwakili oleh induk holding BUMN farmasi PT Bio Farma (Persero), dengan perusahaan produsen vaksin lain, salah satunya Sinovac Biotech Ltd. dari negeri Tiongkok.
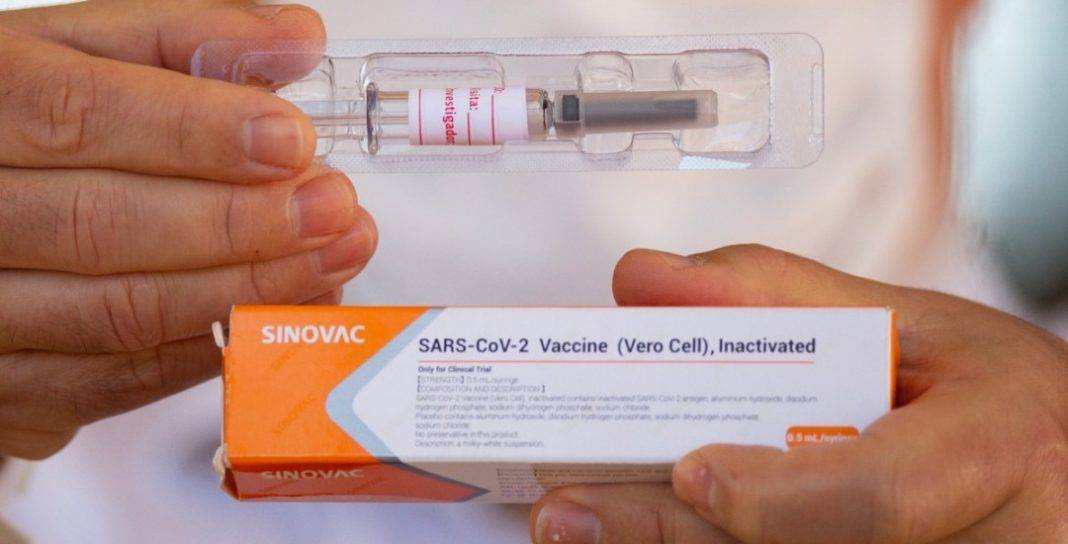
Perkembangan terakhir, Sinovac berhasil melewati tahap II uji klinis vaksin Covid-19 bernama CoronaVac itu. Untuk melanjutkan uji klinis, pihaknya mempercayakan Indonesia sebagai negara tujuan pengujian, dilihat dari karakter spesimen masyarakatnya. Pada 20 Juli 2020, sebanyak 2.400 dosis vaksin CoronaVac telah sampai ke Bio Farma, untuk kemudian diuji secara internal sebelum diaplikasikan kepada para relawan pada Agustus ini.
Lantas bagaimana tahapan sebuah pengujian vaksin sampai bisa digunakan, dan mengapa Pemerintah Indonesia memercayai Bio Farma dan Sinovac untuk menguji calon penawar Covid-19 itu?
Menurut World Health Organization, dalam pembuatan vaksin, umumnya terdapat empat tahap pengujian sebelum akhirnya bisa dirilis ke publik. Kendati begitu, dalam kasus luar biasa seperti Covid-19 yang tingkat penyebarannya sangat cepat, ada tahapan khusus bernama fase gabungan, yaitu memperpendek tahapan umum pengembangan vaksin dengan menggabungkan fase. Sejumlah vaksin coronavirus tengah mencoba uji coba gabungan ini dengan menyatukan tahap I dan II, untuk pertama kalinya menguji pada ratusan orang langsung.
Jika vaksin lolos uji, maka perusahaan pembuat vaksin mengajukan izin peredarannya kepada regulator. Jika sudah menerima persetujuan edar, maka vaksin secara resmi telah ditemukan dan bisa digunakan oleh berbagai negara. Tahap inilah yang sedang dikejar agar pandemi bisa segera dikendalikan.
Mengapa Sinovac?
Sinovac Biotech Ltd. sendiri merupakan perusahaan pengembangan medis yang besar di Negeri Tirai Bambu itu. Dilansir dari Bisnis.com, perusahaan ini berangkat dari tahun 1993 ketika sang Chief Executive Officer Weidong Yin dan tim di Tangshan Yian Biological Engineering Co. Ltd. terlibat sebagai ilmuwan China pertama dalam kegiatan riset dan pengembangan untuk menemukan vaksin dari penyakit hepatitis A yang akhirnya rampung pada 1999.
Atas capaian ini, akhirnya Sinovac resmi dibentuk pada 2001 dengan memproduksi dua kategori vaksin, yakni vaksin untuk influenza dan vaksin untuk hepatitis. Selama perjalanannya, perusahaan telah mengembangkan dan mengomersialkan enam vaksin yang digunakan manusia dan satu vaksin untuk hewan. Di antaranya adalah vaksin hepatitis A dan B, influenza H5N1 (flu burung), vaksin gondok, dan vaksin rabies anjing. Mereka juga yang pertama kali menemukan vaksin influenza H1N1 (flu babi) di dunia.
Sebelum pandemi Covid-19 mengguncang, Sinovac tengah berada dalam proses mengembangkan vaksin baru terhadap enterovirus 71, yang menyebabkan penyakit tangan, kaki dan mulut (HFMD) yang parah di antara anak-anak. Terdeteksinya virus SARS baru di Wuhan pada Desember tahun lalu akhirnya menggerakan Sinovac segera untuk menemukan formulasi vaksin penangkalnya. Dimulai pada akhir Januari 2020, Sinovac menjadi salah satu dari empat produsen dunia yang sudah bergerak ke tahap akhir pengujian calon vaksin Covid-19. Jika berjalan lancar, pihaknya akan mempersiapkan pembangunan pabrik untuk vaksin ini dan diharapkan dapat memproduksi hingga 100 juta dosis vaksin dalam setahun.
Makanya, Pemerintah Indonesia memercayai calon vaksin Sinovac yang bernana CoronaVac ini untuk melakukan uji coba tahap III di Tanah Air. Direktur Utama Bio Farma Honesti Basyir mengatakan, ini juga jadi momentum bagi negara dan Bio Farma untuk belajar banyak soal pengembangan vaksin.
“Transfer teknologi produksi vaksin Covid-19 dari Sinovac ke Bio Farma dilakukan saat uji klinis fase ketiga,” tutur Honesti dalam konferensi pers yang disiarkan di YouTube Sekretariat Presiden, Kamis (16/7) pekan lalu dilansir dari Kontan.co.id.
Honesti menambahkan, Sinovac dipilih sebagai mitra karena mempunyai platform vaksin ataupun metode pembuatan vaksin yang sama dengan kompetensi yang dimiliki oleh perseroannya saat ini. Dengan metode inaktivasi tersebut, Bio Farma sudah berpengalaman dalam pembuatan vaksin lain, contohnya vaksin Pertusis atau batuk rejan.
Bio Farma juga meyakini Sinovac karena sejauh ini uji coba vaksin Covid-19 milik Sinovac diklaim tidak menimbulkan efek samping yang parah pada 90% sukarelawan yang dijadikan percobaan pada interval 14 hari setelah disuntikkan. Justru vaksin yang diberikan telah menimbulkan respon kekebalan tubuh untuk percobaan pada manusia. Ia juga menunjukkan adanya perlawanan daya tahan tubuh untuk melawan infeksi dari virus tersebut.
Mengapa Indonesia sebagai tujuan uji coba?
Terkait pelaksanaan uji coba vaksin tahap III dari perusahaan China ke Indonesia, Sekretaris Perusahaan Bio Farma Bambang Heriyanto menjelaskan, uji klinis vaksin yang dilakukan produsen di negara lain adalah wajar.
“Ini hal lumrah dan berlaku untuk semua di seluruh dunia untuk uji klinis. Bio Farma juga pernah melakukan itu. Pernah uji klinis suatu produk yang dilakukan di Swedia dan Afrika. Memang enggak ada masalah,” ujar Bambang dikutip dari Kompas.com, Kamis (23/7/2020).
Di tahap III ini, Peneliti Lembaga Ilmu Pengetahuan Indonesia (LIPI) Wien Kusharyoto mengatakan bahwa uji coba perlu dilakukan di wilayah yang masih memiliki kasus infeksi yang tinggi. Sehingga, relawan yang divaksinasi masih memiliki kemungkinan yang tinggi untuk terpapar virusnya secara alami. Makanya, Sinovac tidak mengujinya secara masif di China, karena tren infeksinya di sana sudah sangat menurun sehingga uji coba tidak akan berjalan efektif.
“Tahap III untuk membuktikan bahwa vaksin tersebut efektif dan bermanfaat untuk mencegah infeksi sesuai tujuan dan target populasinya. Agar data bisa diperoleh lebih cepat dan dalam jumlah yang memadai,” kata Wien dikutip CNNIndonesia.com, Rabu (22/7/2020).
Ia menambahkan, Indonesia juga menjadi sasaran pengujian vaksin lantaran latar belakang letak geografis, beberapa kelompok umur yang berbeda, beserta kelompok sosial ekonomi yang beragam.
“Faktor-faktor kelompok umur, keadaan sosial ekonomi, dan letak geografis lebih berperan dalam menentukan kondisi kesehatan serta kekebalan tubuh seseorang,” terangnya.
Tak hanya dilaksanakan di Indonesia, uji klinis juga dilakukan di Brazil, Turki, Bangladesh, dan Chile. Hal ini dikarenakan tren kasusnya yang serupa dengan Indonesia, masih terjadi peningkatan dengan angka yang tinggi.
Bambang mengimbuh, ada keuntungan bagi Indonesia dengan uji klinis ini. Keuntungannya, kita bisa mengetahui langsung respons vaksin virus corona pada penduduk Indonesia. Dengan demikian, bisa dilihat kesesuaiannya dibandingkan jika harus membeli vaksin yang sudah jadi.
Mengapa Bio Farma?
Seperti yang diketahui, Bio Farma adalah induk dari holding BUMN Farmasi yang dibentuk pada awal 2020 ini. Bersama dengan PT Kimia Farma Tbk dan PT Indofarma Tbk, Bio Farma bercita-cita untuk mendorong anggota holding BUMN farmasi yang lebih mandiri, baik dalam hal penelitian maupun produksi produk – produknya.
“Pembentukan holding BUMN farmasi ini merupakan salah satu milestone dalam rangka pembentukan ekosistem healthcare di Indonesia, sehingga dari hulu ke hilirnya dapat dikelola semua dengan baik,” tukas Honesti pada Januari silam.
Lini bisnis utama dari Bio Farma sendiri yaitu sebagai produsen vaksin dan antisera, dengan adanya manajemen tersendiri yang fokus kepada sektor tersebut sebagai operating holding. Makanya tak aneh jika Pemerintah menunjuk Bio Farma sebagai penanggung jawab dari riset dan pengembangan vaksin Covid-19 yang sangat dibutuhkan saat ini.
Komitmen Perseroan terhadap penanganan Covid-19 juga telah terlihat semenjak kasus terkonfirmasi muncul di Indonesia pada awal Maret lalu. Ada lima skenario Bio Farma yang dicanangkan dalam menangani penyebaran virus SARS-CoV-2. Kelima skenario itu adalah produksi Real Time Polymerase Chain Reaction (RT-PCR), Terapi Plasma Konvalesen, Mobile Laboratorium BSL 3, dan Pembuatan Viral Transport Media (VTM).
Atas kepercayaannya terhadap Bio Farma, Presiden Joko Widodo menyatakan pemerintah akan menggelar vaksinasi corona secara massal di seluruh Indonesia pada 2021, ketika vaksin sudah resmi diberikan izin beredar.
“Kita pulihkan ekonomi, vaksin ditemukan dan bisa dilakukan vaksinasi massal kepada seluruh rakyat di negara kita,” tegas Jokowi, Selasa, (28/7/2020).
Uji klinis vaksin Covid-19 ini akan dilaksanakan di Pusat Uji Klinis yaitu di Fakultas Kedokteran Universitas Padjadjaran (Unpad). Uji klinis akan mengambil sampel sebanyak 1.620 subjek dengan rentang usia antara 18 – 59 tahun dengan kriteria yang telah ditetapkan sesuai dengan standar pengujian.
“Apabila uji klinis vaksin Covid-19 tahap tiga lancar, maka Bio Farma akan memproduksinya pada kuartal I/2021, dan kami sudah mempersiapkan fasilitas produksinya di Bio Farma, dengan kapasitas produksi maksimal 250 juta dosis,” kata Honesti.
Dilansir dari Tempo.co, Bio Farma akan menggunakan anggaran riset dari pemerintah, sedangkan untuk proses produksi, Perseroan akan menggunakan anggarannya sendiri. Berdasarkan catatan Perseroan, diperlukan dana sekitar Rp 103,7 miliar untuk pengembangan vaksin Covid-19 di Bio Farma. Secara rinci, Rp 40,5 miliar dibutuhkan untuk kolaborasi uji klinis Bio Farma bersama Sinovac ini.
Dana ini juga akan Bio Farma gunakan untuk uji klinis vaksin Covid-19 dari CEPI (Coalition for Epidemic Preparedness Innovations). Sebagai informasi vaksin yang dikembangkan oleh perusahaan riset milik Bill Gates tersebut masih dalam tahap uji klinis I, sehingga belum bisa diujicobakan di Indonesia dalam waktu dekat. Rencananya percobaan vaksi CEPI di Tanah Air akan dilakukan pada akhir tahun ini, jika tahap I dan II ujiklinis berjalan lancar.
Sementara sisanya Rp 63,2 miliar dibutuhkan untuk proyek jangka panjang pengembangan vaksin nasional yang dilakukan sejumlah lembaga penelitian di bawah koordinasi Lembaga Biologi Molekuler Eijkman. Vaksin yang dikembangkan oleh Konsorsium Riset dan Inovasi Covid-19 tersebut akan dijuluki Vaksin Covid-19 Merah Putih.
Vaksin itu kini masih dalam tahap awal di mana Lembaga Eijkman tengah menggodok prototipe kandidat vaksin sehingga jika prototipe itu berhasil maka akan dikirimkan ke Bio Farma untuk dikembangkan lebih optimal sebagai vaksin utuh. Rencananya Pengembangan oleh Bio Farma akan dimulai pada Februari 2021.
“Tahap awal, Lembaga Eijkman akan mengirimkan prototipe kandidat vaksin ke Bio Farma pada Februari 2021. Selanjutnya Bio Farma yang akan melakukan pengembangan,” tutur Honesti.
Ia mengimbuh, pengembangan vaksin nasional dari konsorsium tersebut selanjutnya akan mengikuti beberapa tahap pengujian yang sama dengan vaksin Sinovac sebelum bisa diproduksi massal. Mereka menargetkan akan menyelesaikan riset dan pengembangan vaksin Merah Putih pada akhir 2021 mendatang. Jika berjalan lancar, vaksin hasil pengembangan lembaga nasional untuk Covid-19 itu akan tersedia bagi masyarakat umum pada dua tahun lagi alias 2022.
“Bio Farma akan melanjutkan pengembangan dengan memulai up scaling untuk skala produksi yang akan dilakukan pada Q2 2021, yang diikuti oleh pre-klinis, Uji Klinis fase 1, Uji Klinis 2 dan Uji Klinis 3, yang akan dimulai pada Q4 2021,” kata Honesti.
Sehingga saat ini Bio Farma tengah berfokus pada tiga calon vaksin Covid-19, yakni vaksin dari Sinovac, vaksin dari CEPI, dan vaksin buatan lokal dari Lembaga Eijkman. Diharapkan dengan memacu penemuan vaksin dapat segera mengeluarkan Indonesia dari kondisi pandemi yang sangat memukul masyarakat ini.
Foto: GETTY IMAGES/Andressa Anholete